科技成果
近日,《International Journal of Eating Disorders》(国际饮食失调杂志,中科院1区)在线发表了我院科研人员解析高脂饮食诱导肥胖抵抗表型的表观遗传学基础的研究,文章题为“Epigenetics-Driven Appetite System Disorders and PI3K/AKT Signaling Activation Mediate a Weight Gain Resistance Phenotype Induced by a High-Fat Diet in Male Rats”。我院免疫所郑华军研究员为通讯作者,研究生李明杰为第一作者。
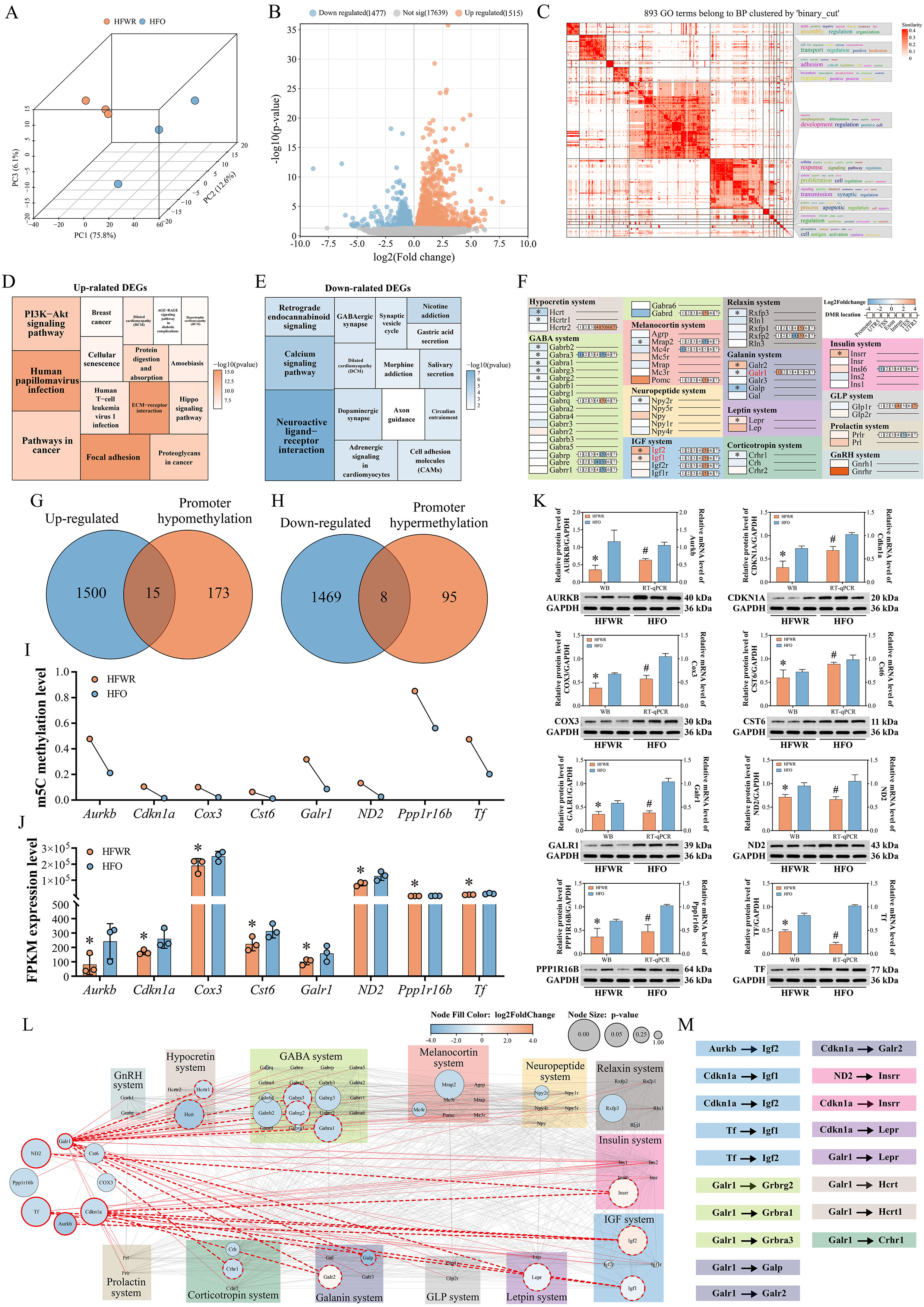
研究组在利用高脂饮食(HFD)构建肥胖大鼠模型时,发现约18.8%的大鼠表现出肥胖抵抗现象(HFWR),其食物摄入量和体重增长显著低于肥胖组(HFO)和正常饮食组(ND),即使切换回正常饮食后仍持续低摄入与体重下降,表现出类似神经性厌食症(AN)的核心特征。由于下丘脑在摄食行为中具有至关重要的作用,为探究肥胖抵抗机制,本研究聚焦于下丘脑的表观遗传与分子调控网络,通过全基因组亚硫酸氢盐测序(WGBS)和转录组测序(RNA-seq),发现HFWR组下丘脑基因组全局5-甲基胞嘧啶(5mC)水平显著升高,甲基转移酶(DNMTs)活性增强,导致关键食欲调控基因(如Galr1、Cdkn1a)启动子区高甲基化及表达下调,直接抑制galanin、GABA等促食欲系统功能,引发代谢与摄食行为异常。
进一步分析表明,高脂饮食诱导的DNA高甲基化还通过激活PI3K/AKT信号通路,引发下丘脑腹内侧核(VMH)的神经炎症与细胞凋亡。免疫荧光结果显示,HFWR组VMH区域AKT磷酸化水平升高,NF-κB核转位及CASP3依赖性凋亡显著增加,提示PI3K/AKT通路异常激活与神经损伤密切相关。此外,HFWR组血清必需氨基酸水平降低,进一步加剧代谢抑制,形成恶性循环。这些发现揭示了表观遗传调控与信号通路互作在肥胖抵抗表型中的核心作用。
研究首次提出下丘脑DNA高甲基化可能是HFD诱导肥胖抵抗的关键机制,为神经性厌食症的病理研究提供了新视角,提示靶向甲基化酶系统或PI3K/AKT通路或具治疗潜力。
 沪公网安备 31010402000778号
沪公网安备 31010402000778号